1. 들어가며
돼지유행성설사(Porcine Epidemic Diarrhea, PED) 바이러스는 코로나바이러스에 속하며, 외막이 있는 양성가닥 RNA바이러스이다. 이 바이러스는 변이가 많은 것으로 알려져 있다. 따라서 PED바이러스는 전 세계적으로 자돈 설사의 주요 원인이 되고 있다. PEDV는 신생자돈에서 거의 100% 가까운 폐사율을 보이며 이는 자돈 일령에 따라 반비례한다.
PEDV 항체가 장내 다른 부분에서 발견되더라도 병리조직학적 변화는 소장 내에서 주로 관찰된다. PEDV 감염 후 장상피세포는 세포 소멸 또는 괴사가 진행된다. 따라서 PEDV 유발된 설사는 장흡수세포의 대량 손실 때문에 영양소 흡수 불량의 결과를 가져온다. PEDV는 이런 유전적 다양성에 더해 선천적 항바이러스 면역에 대항하면서 감염을 일으키는 다양한 방법을 발전시켜 왔고 지금까지 안전하고 효과적인 약이나 사료첨가제는 없었다.
모노라우린(ML, Monolaurin or GML, Glycerol Monolaurate)은 코코넛이나 모유에서 주로 발견되는 천연 물질로 FDA에 안전한 물질(GRAS)인데, 항균력과 항바이러스력을 가진 것으로 알려져 있다. 유망한 결과가 HIV 감염된 원숭이 실험에서 보이고 있는데, 점막 속 원숭이 면역결핍증 바이러스(SIV)의 전이를 효과적으로 막을 수 있었다. 실험실 시험에서 모노라우린은 황열바이러스, 볼거리바이러스, 그리고 지카바이러스에 대한 항바이러스 효과를 보였다. 이는 병원균 외막의 인지질과 지질을 용해함으로써 가능하다.
Projan 등은 모노라우린의 항균력은 세포 복제에서 신호전달의 방해와 연관성이 있다고 보고하였다. 모노라우린(ML or GML)은 포도상균 독소에 감염된 인체 질상피세포에서 케모카인과 사이토카인의 생성을 억제한다. 더욱 중요한 것은 모노라우린은 유해균과 바이러스에 대한 내성이 없다. 이번 실험은 모노라우린의 PEDV에 대한 효과를 평가하는 것이며, PEDV에 대한 모노라우린의 적용에 관해 인사이트를 줄 것으로 생각된다.
2. 실험재료 및 방법
모노라우린 투여 효과를 평가하기 위해 2x2 요인설계 RCBD(Factorial Randomized Complete Block Design)가 채택되었다. 실험은 동일체중의 7일령 32두 자돈을 4그룹으로 나누고 PED바이러스를 감염시키거나 미감염시켰다(두당 PED바이러스 1 x 104.5 TCID50 ). (1) 대조구, (2) 모노라우린 투여구, (3) PEDV 감염구, (4) 모노라우린 투여구+PEDV 감염구로 배치하였고 각 그룹은 적절한 온습도 상태에서 상호 오염이 되지 않도록 철저히 분리 배치하였다.
시험 시작 전 3일간 순치를 하였으며 4일째에 모노라우린 투여구 및 모노라우린+PEDV 감염구에 대용유를 통해 7일간 모노라우린을 투여하였다. 대조구와 PEDV 감염구에는 동일한 양의 대용유를 급여하였다. 그리고 8일째에 PEDV 감염구 및 모노라우린+PEDV 감염구에 PED PBS 용액을 경구 투여하여 인공감염 시켰다. 나머지 두 그룹은 PBS 용액만 경구투여 급여하였다. 11일째에 모든 자돈을 마취를 통해 안락사시켰다. 체중, 설사지수, 사료섭취가 전 기간에 측정되었고, 혈액과 장관 샘플이 분석을 위해 채취된 후 영하 80℃에 보관되었다.
3. 실험 결과
(1) 성장성적
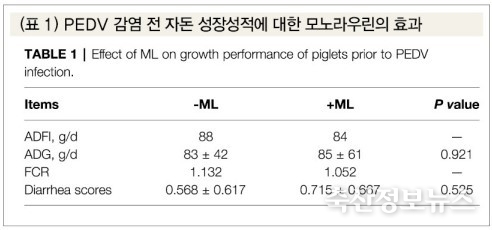
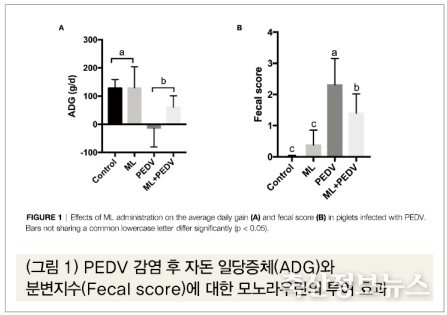
PEDV 감염 전 모노라우린의 투여 시 성장성적에 대한 영향은 없는 것으로 보였다. 일당증체, 사료섭취, 사료요구율, 그리고 분변지수에서 처리구간에 유의적 차이는 없었다(표 1). 하지만 PEDV 감염 후 대조구에 비해 일당증체가 상당히 감소하고 분변지수가 크게 상승하였다(p<0.05). PEDV 감염+모노라우린 투여구에서는 일당증체의 감소폭이 줄어들고 설사지수도 상당히 감소하였다(p<0.05)(그림 1).
(2) PEDV 감염 자돈에서 장형태에 대한 모노라우린의 효과
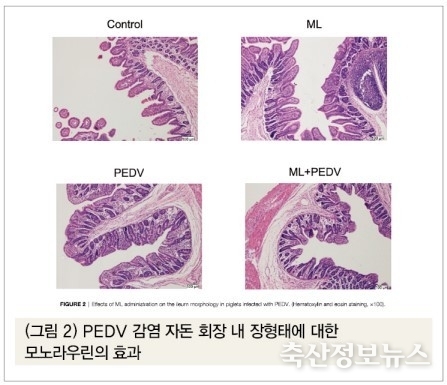
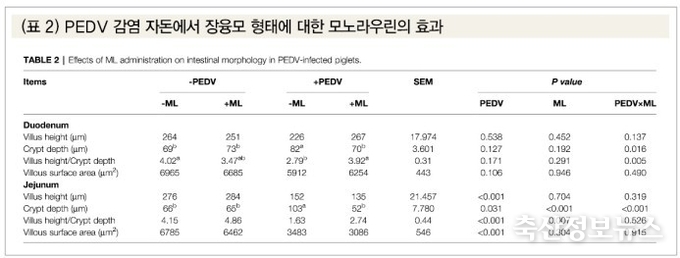
PEDV 감염 이후 관찰된 피해는 주로 자돈의 소장에서 관찰되었다. PEDV 감염돈의 공장 내 융모의 길이와 음와 대비 융모비율, 그리고 융모표면적이 유의적으로 감소한 반면, 모노라우린 투여구에서는 십이지장과 공장 내 음와 대비 융모비율의 유의적 증가가 보였다(p<0.05)(표 2). PEDV 감염구 회장에서는 심한 위축이 보였고 온전한 융모가 보이지 않았다. 모노라우린+PEDV 감염구의 회장 융모는 융모의 회복이 관찰되었다(그림 2).
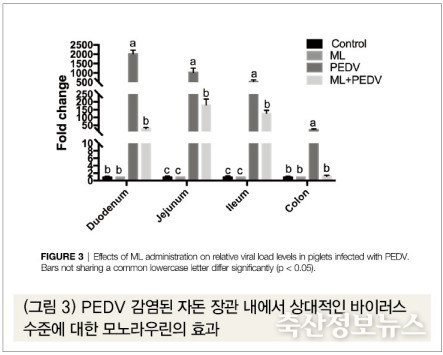
(3) 자돈 장 내에서 PEDV 수준에 대한 모노라우린의 효과
RT-qPCR(실시간 중합효소연쇄반응)에 의한 측정에서 PEDV 감염구의 자돈 결장과 소장 내 전체에서 바이러스가 높게 검출되었으나, 모노라우린 투여구에서만 장관 내 바이러스 수준이 유의적인 감소세를 보였다(p<0.05)(그림 3).
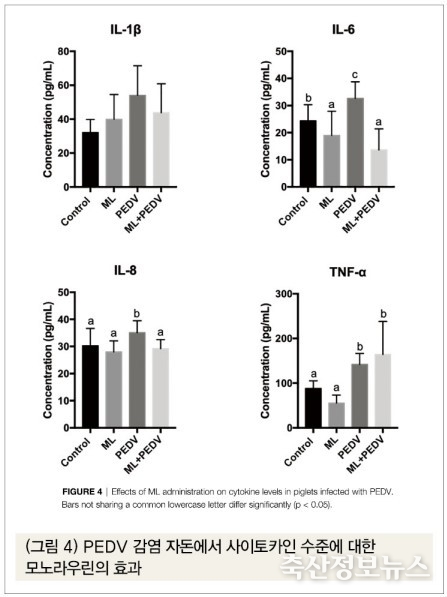
(4) PEDV 감염 자돈에서 사이토카인(Cytokine) 수준에 대한 모노라우린의 효과
대조구와 달리 PEDV 감염구 자돈 혈장 내 염증전구물질인 인터루킨-6(IL-6), 인터루킨-8(IL-8), 그리고 종양괴사인자-α(TNF-α)가 유의적으로 증가하였다. 모노라우린 투여구에서는 모두 인터루킨-6(IL-6)이 유의적으로 감소했고(p<0.05), 모노라우린+PEDV 감염구에서는 PEDV 감염구 대비 인터루킨-8(IL-8)이 유의적으로 줄어들었다(p<0.05)(그림 4). 또 다른 염증전구물질인 인터루킨-1β(IL-1β)는 감소하였으나 유의적 차이가 없었다.
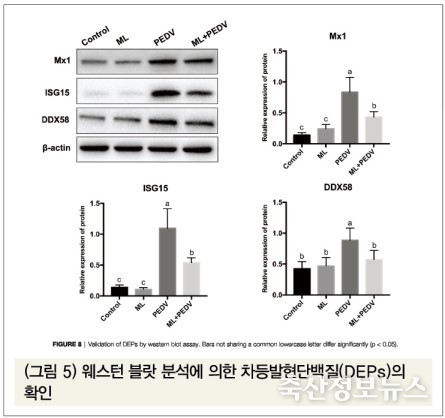
(5) 웨스턴 블랏(Western Blot) 분석에 의한 차등발현단백질(DEPs, Differentially Expressed Proteins)의 확인
웨스턴 블랏 분석에 의한 단백체 분석 결과를 보면(그림 5), 대조구에 비해 PEDV 감염구는 바이러스 감염 시 보이는 인터페론 촉진유전자(ISGs, Interferon Stimulated Genes), 점액성저항성단백질1(MX1, Myxoma resistance protein1), 그리고 염증 관련 유전자(DDX58, DExD/H‐box helicase 58)가 유의적으로 증가했지만, 모노라우린 투여구에서는 유의적으로 감소하였다(p<0.05).
4. 마치며
PEDV는 매우 변이가 심한 코로나바이러스이다. 따라서 광범위한 항바이러스 물질을 찾는 데 노력을 멈추지 말아야 한다. 모노라우린은 광범위한 바이러스에 대한 잠재력이 있는 치료적 물질이라는 증거들이 연구되고 있다. 그러나 PEDV 감염 돼지에 대한 모노라우린의 효과 연구는 많지 않았는데 이러한 부분을 확인하기 위해 연구를 진행하였다. 이번 연구에서 PEDV에 감염된 자돈에게 모노라우린의 급여 효과를 평가하였다.
PEDV 감염은 자돈에서 사이토카인 등의 염증전구물질 발현을 가져왔고, 모노라우린은 염증전구물질의 억제 등 면역조절자 역할을 하면서 PEDV 감염 동안 방어적 효과를 가져올 수 있음을 시사했다. PEDV는 주로 장세포를 감염시켜 소장 내 융모에 심각한 피해를 준다. 본 실험으로 모노라우린 투여로 분변지수를 낮추고 손상된 융모를 회복시키면서 장 기능의 개선이 확인되었다. 비슷한 결과를 Letlole 등도 융모길이와 음와 대비 융모비율이 모노라우린 투여 시 증가함을 보고하였다.
이번 In vivo 실험에서 모노라우린은 외막이 있는 PEDV의 복제를 억제하였는데 이는 바이러스 외막을 손상하는 것과 연관이 있다. 바이러스 감염에 중요 역할을 하는 퓨린단백질 절단 부위가 외막바이러스에 있는데 이는 모노라우린에 감수성이 있다. PEDV는 스파이크 단백질에서 퓨린단백질 절단 부위를 생산하는 위험성이 있는데 이것을 다루는 이상적인 물질이 모노라우린이 될 수 있다. 더불어 최근의 연구에서 모노라우린은 사스바이러스(SARS-CoV-2)에 항바이러스 효능을 보였다. 이처럼 모노라우린은 광범위 코로나바이러스에 대해 항바이러스의 기능을 하고 있다.
인터페론은 잘 알려진 항바이러스 사이토카인이며 생체 내 첫 번째 방어기전이다. 바이러스 복제의 증가 시 인터페론과 인터페론촉진유전자가 극적으로 유발되는데 이는 바이러스 수준과 밀접한 연관이 있다. 본 실험에서 모노라우린은 자돈 소장 내 바이러스 수준을 낮추었다. 동시에 모노라우린은 항바이러스에 연관된 인터페론 경로를 조절함으로써 항상성의 회복을 촉진할 수 있는 것으로 보인다.
■ 자료(논문) 출처 : Monolaurin Confers a Protective Effect Against Porcine Epidemic Diarrhea Virus Infection in Piglets by Regulating the Interferon Pathway. Qian Zhang. et al., Frontiers in Immunology, 2022

【원고는 ☞ ksj@bosah.net으로 문의바랍니다.】















